

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Теория горения 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 [ 86 ] 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 сфере равны, то равны и ге.мпературы, так как в этом .-.пучае не происходит ни массообмена, ни горения. Если / j,j< !o, а скорости массообмена и реакции конечны, 10 на поверхности топлива выделяется тепло и ее температура возрастает пропорционально уменьшению концентрации кислорода. Связь, выражаемая линией теплового ба-.laHca, не зависит от условий массообмена, например от толщины пограничного слоя или скорости дутья, так как скорости тепло- и .мaccooб[eIгa Т1ри этом изменяются в оди-ниКовой пропорции. Далее отметим, что при установившемся режиме весь кислород, который поступает к поверхности топлива, доджей прореагировать. Скорость реакции определяется количеством молекул кислорода, ударяющихся о пов.-рхнос ть углерода в единицу времени, ум!1оженным иа ехр (-E]RT), срачем энергия активации имеет- такое значшще, что при умеренных те.мпературах экспоненциальный множитель пренебрежимо мал, но быстро увеличивается с ростом темне-jiarypH. Отсюда может быть получена вторая связь между / 05 и Т. Данной величине концентрацни кислорода и скорости дутья соответствует определенная скорость массообмена. При данной величине т скорость массообмена MoHier соответствовать скорости химической реакции лишь при вполне определенной температуре поверхности. На рнс. 5-30 проведены кривые материального баланса , отвечающие зависимости т от при различных скоростях потока воздуха. Синусоидальная форма кривых легко объяснима. Если ftt ,. = mg, то массообмеи отсутствует и температуру поверхности можно принять равной нулю. Незначительное уменьшение величины т. может быть обуслов-.тено лишь значительным повышением температуры поверхности, и поэтому вблизи точки кривые круто иодни-чаются вверх. Кривые также поднимаются круто вверх при значениях т., б.тизкнх к нулю, В этом случае концентрация кислорода иа поверхности очень мала и скорость реакции будет соответствовать скорости массообмена лшиь прн значительном нозышении температуры и соответствеино доли эффэктивиых соударений молекул кислорода с новерх-ностью углерода. Ббльшим скоростям массообмена соот-вегствуют большие температуры, поэтому по мере увеличения скорости потока кривые материального баланса смешаются вверх, При установившемся процессе горения должны одновременно выполняться условия теплового и материального балансов. Как видно на рис. 5-3J, кривые теплового и ма-тернальнжо баланса в общзм случле пересекаюгся в трех точках, поэтому указанным условиям соотвегствуют Tpt; нары значений {Т, m.,J. Однако средняя точка соответствует состоянию неустойчивого равновесия, так как если в этом остоянии произойдет кратковременное умеиьи]еиие величины т, то но условию ге11лиа)го баланса темпера- 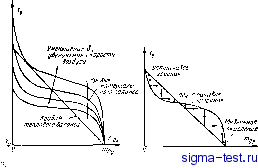 5-30. Kpiuibie reiT.JOBoro материального баланоя. Рис. 5-31. Трк тура возрастает, скорость реакции увеличивается и вели-ч-1на т будет продолжать уменьшаться. Этот нестационарный процесс, изображенный в виде ступеней на рис. 5-31, знанчивтется лишь прн достижении верхней точки равновесия. Аналигичным образэм, если в состоянии неустойчивого равновесия величина т несколько увеличится, то это нр!шсдег к понижению температуры, так как нарупшстся материальный баланс. Начниаютнйся не-станноиарныи процесс заканчивается ли пь при достижений ниж!1ей точки равновесия Нижняя точка равновесия почти сливается с точкой (til 7 ), так как при низких температурах множитель ех) I-EjRT) очеиь мал. Эга точка определяет состояние 2(i(. холодного топлива в холодной атмосфере. Хотя в этом случае и происходит медленное окисление, этим процессом обычно пренебрегают. Ветхняя точка устойчивого равновесия соответствует установившемуся процессу горения, который .бственно и нредставляет практическш ! интерес. Срыв п .4 а м е и и и воспламенение на поверхности углерода. Предположим, что углерод \стойчиво горит в потоке воздуха, скорость которого по-,тепенио возрастает. Как видно на рис. 5-30, при малых скоростях потока условия горения характеризуются низкими температурами и высокими концентрациями кислорода. Однако по мере роста скорости потока устовия устойчивого горения обеспечиваются только до тех пор, пока верхняя точка пересечения не превратится в точку касания. При дальнейшем увеличении скорости происходит срыв пламени п равновесие реализуется лишь при низкой темнературе. Таким образом, в данном случае срыв пламени происходит вследствие чрезмерно большой скорости потока. Срыв пламени другого типа, встречающийся гораздо чаще и обусловленный чрезмерным уменьшением скорости дви-яче1Ц1я газа, связан с влиянием радиации, которое будет рассмотрено ниже. Как показал Сполдинг- (Spalding, 1953, с), условием v ]ц>1ва пламени является 1 + 4Я-1 (5-61) Ж -Г о.. + (..=.. Р о., = 0- Интересно отметить, что при разложении в ряд корня в уравнении (5-61) получается выражение, аналогичное уравнению (5-51) для гомогенной реакции. Величина Е для реакнии окнстения углерода, по-внди-мому, имеет- порядок 30009 кал/моль, кал1моль-К, и есл-1 окись углерода является единственным продуктом 1)еакцни, то 7 1 720К. Отсюда получаем: 7-,= 1,560К, Следовательно, мщ,!1мально возм-тжная температура горищей поверхности весьма высока и соответствеино .максимальная концентрация кислорода на поверхности очень мала. Поэтому в тех случаях, когда горение вообще имеет
|
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |