

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Теория горения 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 [ 55 ] 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 а именно; желтым свечением и дынообразованием. Углеродные частицы образуются наиболее интенсивно при высокой температуре, большой концентрации топлива и значительном удалении зоны реакции от повер,чности топлива. Влияние температуры было исследовано автором (Spalding, 1950), снижавшим температуру путем уменьшения содержания кислорода в атмосфере; при этом в противоположность ожидаашемзся эффекту от уменьшения подвода кислорода пламя становилось менее желтым и 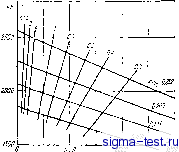 кал/г Рис. 4-21. Температура гореипя углеволородов Я= 10 300 ко.)/г (Г, = 20°С). снижалась склонность к дымообразованшо. Топливо, со-стояшее из компактных молекул, например молекул с бензольным кольцом, легче всего образует углеродные частицы. Если эти частицы теряют значительное количество тепла радиацией, то они настолько охлаждаются, что не могут догореть, когда, наконец, достигают содержащую кислород зону и покидают нламя в виде дыма. Таким образом, аро--матики образуют наибольшее, а парафины с прямой цепью - наименьшее количество дыма; это было установлено Кларком, Хантером и Гарнеро.м (Clarke, Hunter and Garner, 1946). Методика расчета параметра переноса является совершенно общей и может с успехом применяться к окислителям, отличающимся от воздуха. Так, например, для паров 170 азотной кислоты член /-/т/гв уравнении (4-53) следует заменить количеством тепла, выделяющимся при сгорании (при постоянных температуре и давлении) стехиометриче-ского количества топлива с единицей массы паров азотной кислоты. Остальные члены в уравнении (4-53) остаются без изменения. Пример 4-6. Определять параметр переноса при горении п-октана с парами перекиси водорода НОа в камере сгорания пря температуре 5оО°С и давлении 2Э а/па. Топливо подается в камеру сгорания в жидком вяде при 0°С. Дано: Теплота разложения паров НО. при средних температурах 730 /сал/г; продукты разложения-водяной пар и О. Теплота сгорания паров CgHig при ср1;дних температурах 10 боа ка.п/г. Температура кнпения CJdig пря 20 ата 281° С. Разность энталышн жидко1 о СН, при 0°С и 281° С 192 кал/г. Скрытая теплота испарения пря 20 ата 28 кал/г. Средняя теплоемкость паров НоО, 0,5 лгал/г-°С (принято). Решение. Исходя из теплот образования и сгорания, запишем уравнение химической реакции в вида С,НиЧ-25НгОг-8СО,-Ь34НгО--2 153 кал/г ИА Полагаем, что у поверхности топлива газ не содержит окиси углерода и температура поверхности равна температуре кипения при 20 ата. Тогда I г HOa при снижении температуры до 281 С и сгорании с октаном выделяет следуюл1ее количество тепла: 2 153 + 0,5 (500 - 281) = 2 263 кал/г. которое может испарить: 2 263 192 28 топливе! Следовательно, параигтр пе реноса равен 10,3. Горение капель топлива Для очень мелких капель жидкого топлива как выиуж-де!1ная так и естествелпая конвекция становятся несущественными. Поэтому для расчета сгорания можно применить уравнение (4-33), которое уже использовалось нами при анализе горения твердого топлива. Однако в связи с тем, что параметр переноса рассчитывается из балэНса энтальпии, удобнее заменить коэффициент диффузии D коэффициентом темттературопроводности а. Это дает 8(1/с)1п{\-\~В) Экспериментальные данные. Время торения капель определялось экспериментально Годсейвом (God* save, 1953), подвешивавшим капли на кварцевой нити и определявшим по фотографиям скорость уменьшения их диаметра. Аналогичные опыты были проведены Кумагаи и Кимура (Kumagai and Kimura, 1951) п Кумагаи и Изо-да (Kumagai and Isoda, 1952), Хотя естественная конвекция и нарушает сферическую форму пламени [для которой выведено уравнение (4-63)], но вызванное этим увеличение скорости массооб.меиа вряд ли превысит 100%. Следуя Проберту (Prober!, 1946), Годсейв выражает результаты своих опытов через константу испарения n=djti. Из уравнения (4-63) нетрудно найти зависимость х от свойств топлива и среды: Ш/с)Ы1 + В) (4-64) Так как на величину В влияют концентрация кислорода и температура окружающей среды, то я нельзя считать константой топлива. В табл. 4-2 для ряда углеводородных топлив при горении в атмосферном воздухе дано сравнение экспериментальных и теоретических [из уравнения (4-64)] значений к. Величина Х/с принята такой же, как для воздуха при температуре 900° С, средней между атмосферной и 2 000° С. Произвольность выбора величины Х/с является наиболее слабым местом теоретического расчета. Однако учет изменения величины Х/с в зависимости от температуры путем чиелениого интегрирования в каждом конкретном случае представляется слишком с.аожным. Для одного случая такое интегрирование было вьшолнеио автором (Spalding, 1951, а) Как видим, теория и экснери.меРЕТ нахо,1ятся в хорошем согласии. Правда, поскольку прн наличии естественной конвекции следует олидать, что экспериментальные значения X будут превосходить теоретические, то, вероятно, выбрана слишком большая величина отношения Х/с. Однако результаты экспериментов убедительно свидетельствуют о том, что значительное различие молекулярного строения применявшихся тонлив не оказывает влияния на скорость испарепня и что параметр переноса является определяющим кри1срие.м. См. 1акже сноску на стр. 129 н работу Гольдсмнта и Пеннера (GoldsraltU and Penner,1S53).
|
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |