

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Метод вакуумного напыления 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 [ 41 ] 42 43 44 45 46 47 48 49 50 51 52 53 54 является наиболее однородной твердой структурой, получаемой в настоящее время. Хорошо известно, что коррозия обычных кристаллических металлических материалов начинается на тех участках внешней поверхности, где проявляется химическая неоднородность. Аморфные же металлы и сплавы, напротив, должны быть очень устойчивы к коррозии, так как они существенно более однородны в химическом отношении. 9.1.2. Сплавы со сложными химическими составами Ограничиваясь только аморфными сплавами, получаемыми закалкой из жидкого состояния, можно сказать, что их фазовый состав никак не связан с диаграммой состояния. В отличие от кристаллических сплавов, в которых введение новых компонентов может сопровождаться значительными структурными изменениями, аморфные сплавы всегда представляют собой однофазный твердый раствор, что является их особым достоинством. Чистые аморфные металлы, в отличие от аморфных сплавов, содержащих большое число компонентов, при обычных температурах нестабильны, поэтому в дальнейшем мы будем говорить главным образом об аморфных сплавах. Компоненты аморфного твердого раствора могут качественно по-разному влиять на химические свойства сплава в целом. В частности, весьма важным обстоятельством является наличие металлоидов, в больших количествах содержащихся во многих аморфных сплавах. Можно уверенно говорить о том, что химические свойства аморфных сплавов определяются в первую очередь их химическим составом. 9.2. КОРРОЗИЯ АМОРФНЫХ СПЛАВОВ 9.2.1. Аморфные сплавы на основе железа Скорость коррозии Аморфные сплавы железо - металлоид, получаемые сверхбыстрым охлаждением и не содержащие других металлических элементов, кроме железа, обычно характеризуются довольно высокой скоростью коррозии по сравнению с чистым кристаллическим железом или сталью, что вызвано химической неустойчивостью их аморфного состояния. Однако замена в таких сплавах некоторой части железа хромом приводит к тому, что их коррозионная стойкость становится необычайно высокой, превышающей коррозионную стойкость нержавеющих сталей, высоконикелевых сплавов и других подоб- ных материалов. На рис. 9.1 приведены результаты коррозионных испытаний аморфных сплавов системы Fe - Сг - 13 Р - 7 С и кристаллических сплавов системы Fe-Сг при 30°С в 1 н. водном растворе NaCl, в котором концентрация NaCl в два раза больше, чем в обычной морской воде. Скорость коррозии определялась по умень- шению массы образца и показана на рисунке как ylllll-рации хрома [3] [в данной главе химический состав сплавов описы-аеТя ор уУ в которых ,Г&Л Т=;= ТГ- ростей коррозии различных аморфных сплавов на основе железа, двойных сплавов Fe - Со, некоторых нержавеющих сталей и высоконикелевых сплавов при 30°С в 1 н. водном раство- ре НС1 [4, 5]. Как видно пз этих ри- I ff,if сунков, для чистого кристаллического I железа легирование химически более активным хромом приводит к увеличению скорости коррозии в обоих водных растворах. Для сплавов Fe - Сг и нержавеющих сталей, хотя в водном растворе НС1 большая часть пх внешней поверхности сохраняет металлический блеск, в некоторых локальных участках появляются питтин-ги, которые растут внутрь материала, и скорость коррозии повышается именно за счет питтинговой коррозии. В аморфных сплавах, напротив, даже в водном растворе НС1 ппт-тинги не возникают. Как можно судить по рис. 9.2, скорость корро-1. юо зии аморфного сплава на железной \ -основе при отсутствии других ме- таллических элементов {х=0), т. е. Е скорость коррозии сплава Fe- > I3P -7С, выше скорости корро- зии чистого кристаллического желе- за. Из этого сравнения напрашива- ется вывод, что аморфные сплавы металл - металлоид, не содержащие кроме основного металла других металлических элементов, обычно имеют более высокую скорость коррозии по сравнению с чистым 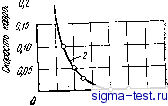 л i б 8 Ю й /i- Сг, %т) Рис. 9.1. Влияние хрома иа скорость коррозии кристаллических сплавов Fe-Сг (1) и аморфных сплавов Fe-Сг- 13р-7С (2) в 1 н. водном растворе NaCl 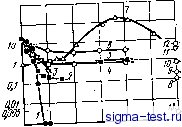 В оригинале описанный вид местной коррозии назван щелевой коррозией. В отечественной литературе обычно рассматривается питтииговая и щелевая коррозия. Поэтому в том случае, когда ясно, что речь идет о коррозии в искусственно созданных дефектах типа щелей, при переводе ис-пользова.ч термин, щелевая коррозия , во всех остальных случаях- термин питтииговая коррозия . Прим. ред. го J0 W 60 Рис. 9.2. Влияние концентрации второго металлического элемента (х) на скорость коррозии кристаллических и аморфных сплавоа иа основе железа в 1 и. водном растворе НС1 при 30°С: / Fe-х Сг-13 Р-7 С; 2 - Fe- jcMo-13Р-7С; 5 -Fe-JcW- 13Р-7С; 4 - Fe-x Ni-13Р- 7C; 5 - кристаллические сплавы Fe-x Ni; 6- Fe-x Co-13P-7C; 7-кристаллические сплавы Fe- xCr; 8 - хасталлой В; 9 -Ni- ЗОМо; /<?-нержавеющая сталь 316; - нержавеющая сталь 304; /2 -ЗОСг-2Мо ; /3 -хасталлой X; /4 -хасталлой С кристаллическим металлом, испольэованном в соответствующих аморфных сплавах в качестве основы. Добавление в аморфный сплав типа металлеталлоид второго металлического компонента, как видно т рис. 9.3 и 9.4, снижает скорость коррозия аморфного сплава, однако величина этого снижения зависит от того, какой металл добавляется. В частности, добавление хрома в аморфные сплавы на железной основе является эффективным, но здесь важ-
10 20 ЭО М, %Ш) Рис. 9.3. Влияние легирующих элементов (М) на скорость коррозии аморфных сплавов Fe-Л1- 13Р-7С в 0,1 н. водном растворе НС1 при 30=С (элементы М указаны на рисунке; штриховой линией локазаи случай двойных кристаллических сплавов Fe-Сг)
0 5 10 Рис. 9.4. Влияние легирующих элементов (М) на скорость коррозии аморфных сплавов Fe- Af-13Р-7С в 0,1 н. водном растворе h2so4 при ЗОС (элементы М указаны на рисунке) яую роль играют также сорт и концентрация металлоидных атомов. В целом, легирование хромом, при котором не наблюдается существенных потерь массы за счет корразии в кислотах при обычных температурах, возможно в широком диапазоне концентраций в аморфных сплавах на основе железа, что облегчает их цроизвод-ство. Добавление второго металлического элемента повышает коррозионную стойкость не только в водных растворах соляной кислоты, та же тенденция имеет место и водных растворах серной и лзОтной кислот. Коррозия и поляризационные кривые Всем известно, что железо ржавеет. Химическая реакция между кислородом и водой, с одной стороны, и железом, с другой, в результате которой образуется ржавчина, выглядит следующим образом: 4Fe--3 02-b2H20 = 4FeOOH. (9.1) По реакции (9.1) получается, что железо реагирует целиком. Однако в действительности движение электронов (е) в металле и гидроксильной группы (ОН-) в воде приводит к тому, что сначала атомы железа превращаются в ионы железа (Fe+j. Практи- (9.2> (Э.3> (9.4> чески реакция образования ржавчины (9.1) является результатом протекания трех реакций: 4 Fe (металл) = 4 Fe2-1- (в воде) -f 8 е (в металле); 2О2 (в воде) -I- 4 Н2О -Ь 8 е (в металле) = 8 ОН (в воде); 4 Fe2-1- (в воде) О2 (в воде) 8 ОН (в воде) = 4 Fe ООН 2 НО. В реакции (9.2) атомы железа, переходя в раствор, становятся двухвалентными положительными ионами, при этом электроны остаются в металле. Эта реакция является реакцией окисления, которая называется также реакцией коррозии металла, или анодной реакцией. Если бы протекала только анодная реакция, то в водном растворе собирались бы положительные ионы, а в металле скапливались бы электроны, вследствие чего коррозия должна бы мгновенно прекратиться. Для продолжения реакции коррозии необходима нейтрализация ионов железа в водном растворе и электронов в металле, т. е. необходимо, чтобы поддерживалась электрическая нейтральность и в водном растворе, и в металле. Реакция, при которой происходит продолжение коррозии за счет нейтрализации растворенных ионов металла и утечки электронов из металла, называется катодной реакцией коррозии. Катодная реакция протекает за счет того, что в естественных растворах, в частности в воде кроме ионов кислорода всегда имеются и ионы водорода. Ионы водорода (Н+), присоединяя электроны, превращаются в молекулярный водород (Нг) по реакции 2Н-1- (в воде) -f 2е (в металле) = Нг (газ). (9.5> Коррозия металлических материалов в действительности происходит в условиях, когда скорости перемещения электрических зарядов в приведенных выше анодной и катодной реакциях одинаковы т. е. когда сохраняется электрическая нейтральность как металла так и окружающего его раствора. Если в раствор, помимо исследуемого металла, поместить какой-либо другой малоактивный металл, например, платину, и соединить их внешним электрическим контуром, то на исследуемом металле будет протекать только анодная реакция, а на платине - только-катодная реакция. Таким образом, можно регулировать электрический потенциал и электрический ток в металлическом электроде подключенном к внешнему контуру. В данном случае платина является анодом, а исследуемый металл - катодом. Увеличение окислительной способности раствора приводит к повышению потенциала и если измерять электрический ток при данном потенциале, то по-величине электрического тока можно оценить скорость коррозии в: соотв,етствии с окислительной способностью данного раствора. Получаемые таким образом кривые з.ависимости электрического тока от электрического потенциала называют поляризационными кривыми. Повышение окислительной способности раствора равиозначио смещению потенциала в положительную сторону. Прим. ред. Классические поляризационные кривые приведены на рис. У.5. Сначала кислород из воздуха переходит в водный раствор, после чего потенциал металла повышается от потенциала катода (-) до потенциала анода ( + ). При этом течет отрицательный электрический ток, складывающийся из малого тока восстановления ионов кислорода и большого тока восстановления ионов водорода. Этот суммарный ток всегда отрицательный. Его протекание повышает электрический потенциал. По абсолютной величине этот ток невелик. Анодный ток, соответствующий анодному растворению, по абсолютной величине равен катодному току, а потенциал, отвечающий такому состоянию, является потенциалом коррозии. Так как во внешней цепи поддерживается равновесие, растворение металла начинается уже при электрическом потенциале, отвечающем точке 3. Анодный электрический ток (ток коррозии) пропорционален скорости коррозионного растворения. Онвозрастает с увеличением потенциала. Диапазон потенциалов, соответствующий активному растворению металла, называется областью активного состояния. 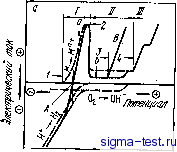
Рис. 9.5. Обычная (типичнаи) поляризационная кривая (а) и поляризационная кривая в случае самопассивации (б): J-активное состояние; Я -пассивное; Я/ -перепассивация- А - потенциал коррозии; 5-питтииговая коррозия; экспериментальная кривая;----истинный электрический ток (Н-- растворение металла,---электричеекий ток образования водовода и восстановления кислорода);----суммарный катодный ток образования водорода и восстановления кислорода Когда окислительная сила раствора возрастает, окисленные ионы металла образуют оксиды, гидрооксиды и оксиды-гидрооксиды, покрывающие тонким слоем поверхность металла. При этом <;корость коррозии может уменьшаться в несколько раз. Такое состояние металла называется пассивным состоянием, или пассивацией. Так как пассивное состояние возникает при большей окислительной силе, чем активное состояние, в пассивирующей пленке ионы металла обычно имеют большую степень окисленности, чем в по xL! CKSr L°yXlT учитывается растворение активной области. Кроме того, если в растворе присутствуют, например, хлорид-ионы, разрушающие пассивирующую пленку, то в области потенциалов пассивации во многих металлах появляется описанная выше питтииговая коррозия (выше потенциала, отвечающего точке 5). При значениях потенциала, превышающих потенциал в точке 4, вследствие сильного окисления ионы металла, формирующие пассивирующую пленку, еще больше окисляются и, если химические продукты такого окисления могут переходить в раствор, электрический ток растворения снова возрастает. Это состояние называется перепассивацией. При еще более высоких потенциалах происходит.электролиз воды и выделяется газообразный кислород. Как следует из рис. 9.5,6, если максимальный ток в активном состоянии ip меньше катодного тока ic при данном потенциале, то потенциал снижается и положительный и отрицательный токи уравновешивают друг друга. В этом случае потенциал коррозии существенно повышается, что соответствует пассивации металла или сплава. Таким образом, простым выдерживанием сплава в растворе можно перевести его в пассивное состояние. Этот процесс называют самопроизвольной пассивацией, или самопассивацией. Условия, обеспечивающие высокую коррозионную стойкость данного металла, сводятся к следующим. Во-первых, потенциал коррозии, соответствующий началу активного растворения I, должен быть высоким (если потенциал коррозии высокий, то скорость коррозии низка; желательно, в частности, чтобы потенциал коррозии находился в области потенциалов пассивации, так как в этом случае возможна самопаосивация). Во-вторых, потенциал 2, отвечающий образованию пассивирующей пленки, должен быть достаточно низким (в этом случае пассивирующая пленка возникает при слабой окислительной способности раствора). В-третьих, необходим высокцй потенциал начала питтинговой коррозии 5 и высокий по-тенциа1л перепассивации 4. Что касается электрического тока, то нужно, чтобы максимальный ток активного растворения а был мал (это отвечает малой скорости активного растворения, а это, в свою очередь, соответствует тому, что при увеличении окислительной способности раствора должна происходить самопассивация). Электрический ток пассивации также должен быть мал (это условие означает, что образующаяся пассивирующая пленка обладает хорошими защитными свойствами). Таким образом, кривые поляризации содержат всю информацию, необходимую для оценки коррозионной стойкости металлических материалов. Поляризационные кривые аморфных сплавов на основе железа На рис. 9.6 показан пример поляризационных кривых, полученных путем измерения электрического тока при различных потенциалах после выдержки аморфного сплава Fe- 10 Сг- 13 Р - 7 С в течение 1 ч в 1 н. водном растворе NaCi и в 2 н. водном растворе h2so4 [31. При отрицательных значениях потенциала фиксируется катодный ток, а при положительных - анодный. Электрический по-
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |