

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Гальванические покрытия в машиностроении 1 2 [ 3 ] 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 ОБЩЕтехиичЕские сведения Химвя 8. Соотиошеннс плотности и юнцентрации одных щелочных растворов прн 20 С Плотность, г/см 1.00 1,01 1,03 1.05 1,07 1.09 1,11 1,13 1.15 1,20 1,25 1.30 1,35 1,40 1,45 1,60 Кснцеитрадия, мае. доля, % NaOH 0,1Б 1,04 2.84 4,65 6,47 8,28 10,10 11,92 13,73 18,25 22,82 27,41 32,10 36.99 42,07 47.33 0.20 1.29 8,48 К, 66 7,82 9,96 12.08 14,19 16.26 21,38 26,34 31,15 35,82 40.37 44,79 49,10 NasCO, I.I4 3.05 4,98 6.90 8,85 10.74 12,52 14,35 17,90 4. Соотношение плотности н вониентрации растворов аммиака при 20 С
6. Концентрация растворов некоторых солей в зависимости от плотности прн го* с плотность, т/си Концентрация, мае. доля. Сернокислая кедь
Плотность, г/см 1,109 I.I33 lil58 1,183 1.209 Кон цен трацня, Мао. доля. 10 12 14 1в 18 Серноннслыб цннк
е. Металл в пересчете Ra его соль или окисел
7 ствмдвртиые лектродвые потенивалы LJSioB в водных растворах 2!тельно и. . в. (ряд напряжений) li/li+ Rb/RM К/К+ Вв/ВаЧ Sr/Sr + Са/Са - Na/Na+ Al/AIH TI/TIH Zr/Zr+ Т1/Т1Ч v/v + Nb/Nbt Cr/Cf+ Zn/Zn+ Cr/Cr + Fe/Fe+ Cd/C<)+ In/In * Ti/Tl+ -3.046 -2.926 -2,926 -2.90 -2,89 -2.87 -2,714 -2,37 -1,847 -1,662 -1,628 -1,629 -1,21 -1,180 -0, 91=+lj -0.763 -0,744 -0,440 -0,403 -0,342 -0,336 CO/Co+ Nl/Ni-t Мо/МоЧ Sn/Sn-t pli/Pb-t Fe/Fe4 D,/2D HJ2H+ Sb/SbH As/As + Bl/Bi-t Cu/CuH Со/СоЧ Ru/Ru-> Cu/Cu+ 2Hg/Hg- Ag/Ag+ Pt/Pl + Au/Au4 Au/АШ -0.277 -0.260 - 0.20 -0.136 -0.126 -0,036 - 0,0034 0,000 -t-0,24 --0,247 - -0.32 - -0.337 --0.4 -0.46 --0.621 --0.789 -t-0,799 -t-0.864 -t-0,987 -i-1.2 -t-1,60 -t-1,691 8. Элект,-эохимические гквивадевты
Продолжение табл. 6
fl. Значения постоянных а и Ь дли реакции катодного выделсннн водорода на разных металлах при 20 С
 Рис. I . 1 Xf. .а -la p..[i ru :лро,;ыша реалнзуС1СИ, i;oifl:i noi;cixHOCTb катода почт полностью блокирована поверхностно-активиы.м веществом. Скорость 1.ротекания всего процесса в целим определяется стадией, сопровождающейся нанбольи;н,м торможением, иричинамн которою могут быть замедленный перенос разряжающихся ионов к катоду, т. е. концентрационное 11ерена11ряЛ!ение (1-я стадия); замедленный разряд ионов, ко;Орьгй обусловлен трудностью переноса заряда 11ерез двойной электрический слой н изменением физико-химического н энергетического состояния ионов (дегидратация, десольватация, ра;пад исмплексных ионов и др.), т. е. электрохимическое перенапряжение (2-я стадия); трудности, связанные с построением кристаллической ре-HieTKH (замедленная диффузия ад-ато-коп или ад-ионов по поверхности каюда к .местам роста кристаллов, затруднения при внедрении атомов в кристаллическую решетку илн при образопаиии flujx- или трехмерных кристаллических зароды111С11), т, е. крн-е;аллизацпонное переианряжеине (3-я стадия). Значения кристаллизационного перенанряжеЕ1ия с[1а?.нительно невелики и зависит от природы металла и состояния поверхности катода, кого-Р)е во прем электролиза меняется п результате адсорбции посторонних iKjHOB и молекул органических веществ. Для многих металлов (Sn, РЬ, Ag, lit;, Cd и др.), имеющих сравнительно большие токи обмена, кристаллизационное перенапрнжсние составляет всего лишь несколько .милливольт и возникает, когда электрохимическое гер-еиаиряжсние при выделении этих металлов очень мало, наприме[), ирн электро.шзе растворов простых ео.тей этих Meia.M.ioB в отсутствие поверх-ностно-акгнвных добавок. Большое значение при элекролизе имеет та;; называемое пассиваиионное леренаиряжение, или перенапряжение ипгибирования, обусловленгюе прочной адсорбцией посторонних частиц на поверхносш электрода. Кроме перечисленных причин торможения электродного процесса, существуют факторы, затрудняющие процесс вследствие медленного протекания одной нз химических реакций, со став.1]яю!1;их суммарную электродную реакцию. Это явление носит название химического (реакционного) перенапряжения. Таким образом, процесс выделения металла иа катоде протекает при сдвиге, иногда весьма значительноу, потенциала (но сравнению с равновесным) в сторону отрицательных значений для преодоления указанных торможений. После смещения потенциала катодз в сторону отрицательных значени.т (по сравнению с равновесным потенциалом выделяемого металла) в растворе начинается образование кристаллических зародышей выделяемого металла на электроде. Первоначальн.. образуемые зародыши металла имеют толщину нескольких атомных слоев, н слой этих зародышей может рассматриваться как двухмерный. Дальнейший рост двухмерного зародыша может происходить как в плоскости самого зародыша, так и в иаправленки, перпендикулярном плоскости двухмерного зародыша. На рис. I схематично показан двухмерный зародыш и нап1)авлення его роста. Рост первоначального двухмерного зародыша может принципиально идти по трен направлениям, указанным на рис. I стрелками /, 2 и 3. Энергетически наиболее вероятным нанраиленнем роста является направление /, так как работа образования зародыша в положении / минимальна п минимально число свободных граней вновь образуемого зародыша. В положении 2 число свободных граней нового зародыша будет иа одну больше, и поэтому больше работа его образования, и, следовательно, рост двухмерного кристалла в нап))авлеиин 2 будет менее вероятен, чем в направлении /. Наконец, наименее вероятным направлением роста является направ-ленне 3. ОбЫПЮ peer объемного кристалла выделяемого металла идет но всем напраш!0К115!М, хотя скор( сть роста в отдельных направлениях более высокая Наряду с образованием зародышей металла иногда возможен процесс их окислегия. т. е. раствореття, и наблюдаемая скорость роста ыета.1ин.,че-ского осадка является разнесгью скоростей образования и растворения кы-деляе.чого металла. Скорость роста металлимеекого катодного осз.чка в различных направлениях sai;:ioHT от режн.ма электролиза. При низких значениях поляризующего KaTOjiHoro тока и иезначителыюм смещении катодного потенциала от равновесного 31;ачения может произоГин замедление рост;: кристалла в отдельных наирарле11иях, и к!1!еталл начнет расти то, ько Е одном наьравлепии, приобретая нитевидную форму. Такая форма наблюдается при кристаллизации Ag из раствора AgNOj в присутствии некоторых добавок, например олеиновой кислоты. Это связано с тем, что при малых плотностях тока происходит пассивация всех, кроме Ofli.oii, граней кг!сталла вследстБие адсорбции на них поверхностно-активных веществ, которые всегда содержатся в растворе. Адсорбция по.воляет на одной из 1раней поддерживать даже при налой силе тока так\ю плотность тока, которая превышает скорость поступления к этой грани поверхностно-активных веществ и обеспс- нвает рост этой грани, С росте-.; еьЛЬ! гюляризую.пего тока скорость (ота осадка иа катоде ьоз-растает. При это.м увеличиьастея число возникающих в раз.тнчиых точка.ч растущего осадка новых кристаллических зародьнней. Расстояние между новыми ЕОЗ>1икаощигп1 зародь.шамн п их число злиисятот конце it рации раствора, с \ сьььтенпсу. которой расстояния и число зародь!шеи ьозр.астают. Большее влияние на cip ктуру осад-коп при катодном выделении металлов оказывают поверхноетг.с-шсшсные вещества. содери;ащиеся ь растворе, которые, адсорбируясь па растуши.х гранях кристалла, i.-c вируют и,ч и приводят к возниктовепию новых многочислен! ьх кристаллических зародышей, благодаря ч<ку в этих условиях образуются плотные мелко-крнстал.1К1ескис ссадт.н. Часто орга- нические добавки входят в состав катодных осадков. Получению мелко кристаллических плотных катодных по крытнй способствуют и другие факторы, приводящие при дайной силе тока к увеличению катодной поляри зации: на1!ример, использор.аиие электролитов, содержащих комплексные ионы выделяемого металла По степени трудности восстановления ионов на катоде металлы условно можно разделить на три группы. К 1-й группе относятся металлы, восстанавливающиеся с низким перенапряжением (Sn, Cd, Zn, Си, Ag и др.). Вькте.текие этих металлов происходит U основном I а активных участках катодов без зачетной химнческс; ! поля-ризаиии. ieтaллы 2-п группы, восстаиавли-вающиеся с высоким перенапряжением (Fe, Со, Ni, Ст, iMii и др.), склонны и пассивированию. Существование на катоде такой пленки вследе1вне адсорбции чужеродных частиц повышает перенапряжение и позволяет осаждать такие иста.тлы из некоторых нх солей. При этом покрытия не отличаются высокой чистотой и содержат примесн в виде окиси, гидроокиси, водорода и др. К 3-н ipyune отиссят металлы, которые пока не удается получить из водных электролитов (AU), W, Nb, Та, Mg, Ti и др.). Для -гих металлов характерна повышенная реакционная способность по отношению к среде и образование поверхностных соединений. Они выделяются на катоде в виде тонкого слоя окиси ити 1и,лроокнеи. Рассеивающая и кроющая сиосоС-ностк электролитов. Распределение га.льваиического покрытия по поверхности детален лрактмчее;-,)] шжогда не бывает равномерным: па кромках и вы-сгупа.х itVHHHHa покрытия значительно больше, чем во впадинах детали. В глубоких пазах г, отверстиях покрытия часто отсутствуют. НсраВ1юмерность покрытия зависит от Jacпpeдeлeиия снлопы,: лпн1111 электрического тока по проунлкт катода. Распределение тока по ),от>ерхиости катода зависит; от геометрических факторов - размера и формы эл(К-тродсв и в;:;ны, располс;!\ения электродов относительно друг друга и отиоеителько стенок э.юктролитичс-ской ячеГти; от электро.чимнческнх факторов - электропроводимости Химия 4 3 Рис. 2. Ячейка Филда: / - анод; S - дальний катод; 3 - ближний катод: 4 - изолирующая перегородка электролита и характера изменения катодной поляризации с изменением плотности тока. Распределение металла, в свою очередь, зависит от распределения тока и от характера изменения выхода металла по току с изменением плотности тока. Различают первичное и вторичное распределение тока. Первичное зависит от геометрических параметров; 01ю наименее равномерно и наблюдается прн отсутствии электродной поляризации; характерная особенность первичного распределения тока - его независимость от абсолютных геометрических размеров ванны; оно одинаково для геометрически подобных систем любого масштаба. Вторичное, действительное, распределение тока отличается от первичного большей равномерностью; оио зависит от поляризуемости катода dEldi, удельной электропроводимости раствора к и геометрических размеров системы. Способность электролита изменять первичное распределение тока, обусловленное только соотношением геометрических параметров, называют рассеивающей способностью электролита. Обычно этот термин употребляют и Рнс, 8. Ячейка Херринга н Ьтюма: / - перфорированный анод; 2 - дальний кагод: 3 - ближний катод; AI, Л2, A3 амперметры для оценки способности электролита давать равномерные по толщине покрытия. Поэтому принято различать рассеивающую способность электролитов по току (РСт) и рассеивающую способность электролитов по металлу (РСм), хотя второе понятие нельзя считать вполне строгим. Для экспериментального определения рассеивающей способности используют электролизную ячейку Филда (рис. 2) или ячейку Херринга и Блюма (рис. 3). В первом случае рассеивающую способность PC, %, определяют по формуле К-М где К. - первичное распределение, выраженное отношением расстояний от анода до дальнего и ближнего катодов, т. е. АС = /д б; !Л - вторичное, фактическое, распределение металла, выраженное отношением масс метэллов, выделившихся на ближнем и дальнем катодах, т. е. М = Мб/Лд. Во втором случае для определения рассеивающей способности, %, пользуются формулой PC = 100. Отношение К принимают равным пяти. Максимальная рассеивающая способность достигается тогда, когда привес металла на ближнем н дальнем катодах одинаков, т. е. М = 1, н, следовательно, PC =80%. Значения рассеивающей способности д.тя некоторых типовых электролитов приведены в табл. 10. Для экспериментального определения PC электролитов применяют также 10. Рассеивающая способность электролитов (по Херрннгу и Блюму)
ячейки с угловыми катодами и щелевые ячейки. Под мнкрорассенвающей способностью понимают способность электролита образовывать равномерные осадки иа микрорельефе поверхности катода. Микрорассеивающую способность выражают отношением толщин покрытий на различных участках ми-кроуглублеинй 63/62 и 62/61 1бз и 62 - толщина слоя покрытия на вершине угла и на средней части одной из сторон выемки соответственно (рис. 4)1. По мере увеличения отношений 63/62 и 62/61 возрастает выравнивающая способность электролита, на которую влияют значение катодной поляризации и введение в электролит специальных выравнивающих добавок. Кроющая способность зависит от условий электролиза, природы покрываемого металла, состояния его поверхности (пассивное или активное), неоднородности поверхности металла по составу и структуре, характера предварительной обработки электродов перед покрытием и др. Она характеризует полноту покрытия, так как толщина слоя ие принимается во внимание. На рис. 5 схематично показана разница между кроющей и рассеивающей способностями электролита на электроде в ячейке Хулла. Рассеивающая способность представлена как отношение bJ6i, где 62 - толщина покрытия в середине катода, а 61 - на краю катода. Кроющая способность t определяется как величина покрытой поверхности катода в ячейке Хулла. В качестве меры кроющей способности иногда принимают ту минимальную плотность тока, при которой только начинается осаждение покрытия. Для изучения кроющей способности используют угловые катоды с различными углами и длинами углов, щелевые катоды, шлицевые ячейки, ячейки Хулла или перфорированную шкалу Пэиа. Кроющая способность увеличивается с повышением плотности тока. Это используют прн хромировании. Первоначально производят кратковременное хромирование с повышенной плотностью тока (толчок); рабочую плотность тока устанавливают после того, как все изделие покроется тонким слоем хрома. Кроющая способность ромовой ванны на никеле, алюминии 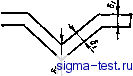 Рис. 4. Угловая риска для определения микрорассенвающеб способности и его сплавах хуже, чем на меди и железе. Она может быть улучшена путем осаждения соответствующего промежуточного слоя. Если рассеивающая способность важна для всех гальванических ванн, то кроющая способность имеет существенное значение тачько для хромового электролита. Выход по току. На катоде кроме осаждения металла происходят и другие процессы: выделение водорода, восстановление металлов до более низкой валентности (Fe** до Fe*), а также восстановление органических веществ, попавших в электролит. В результате этого суммарное количество электричества, затрачиваемое иа выделение вещества, превышает количество электричества, рассчитанное по закону Фарадея. Это явление характеризуется коэффициентом полезного использования тока, или выходом по току (%), который определяется следующим отношением: ВТ = 100 = Уп 100, где Qt, Qn - количества электричества, соответственно теоретически (по закону Фарадея) и практически рас- 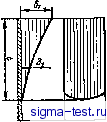 Рнс, 5. Рассенваюнан и кроющая способности покрытия на электроде нчейкн Хулла
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |